La persistance de la mémoire à long terme : découverte d’une interaction protéique clé
Dans une avancée majeure en neurosciences[1], des chercheurs ont découvert que l’interaction entre la protéine KIBRA et la protéine Kinase Mzeta (PKMζ) permet de maintenir la mémoire à long terme, malgré la nature transitoire des molécules impliquées. Ces interactions contribuent à renforcer durablement et de manière ciblée les synapses responsables de la mémoire à long terme. Cette découverte pourrait ouvrir la voie à de nouvelles perspectives thérapeutiques pour les troubles cognitifs affectant la mémoire, tels que la maladie d’Alzheimer.
1. Découverte du complexe protéique KIBRA- PKMζ
La mémoire à long terme pose une question fondamentale en neurosciences : comment des protéines synaptiques, dont la durée de vie est en moyenne de quelques jours, peuvent-elles contribuer au maintien des souvenirs pendant des années ? Depuis les premières théories sur la mémoire à long terme[2], de nombreuses recherches ont été menées pour comprendre les mécanismes moléculaires de cette persistance.
La potentialisation à long terme (« PLT ») est reconnue comme un mécanisme clé de la mémoire, qui permet le stockage des souvenirs pendant plusieurs années, et repose sur le renforcement sélectif des synapses (les structures qui connectent les neurones entre eux). Le phénomène de PLT repose sur la stimulation répétée et synchronisée de certaines synapses (on parle de renforcement sélectif de ces synapses, dites synapses « fortes »), augmentant ainsi l’efficacité de la transmission synaptique. De fait, la connectivité entre ces synapses est cruciale pour permettre le fonctionnement des réseaux neuronaux responsables de la mémorisation à long terme.
Pour autant, les molécules impliquées au cours de la PLT (notamment dans sa phase tardive) restent encore mal comprises. Le rôle de la protéine PKMζ avait été mis en évidence lors de recherches antérieures sur des modèles murins[3] qui ont montré que l’inhibition de cette protéine contribue à effacer les souvenirs des lieux, tandis que l’augmentation de sa concentration favorise le maintien de la PLT[4]. Qui plus est, cette augmentation de la concentration de PKMζ persiste pendant plusieurs semaines dans les neurones de l’hippocampe, une région essentielle pour la cognition, la mémoire spatiale et l’apprentissage. Pour autant, la durée de vie des molécules échangées entre les synapses est généralement très courte (quelques jours en moyenne), ce qui ne concorde pas avec la persistance des souvenirs pendant des années. De fait, jusqu’à présent, la manière dont la PKMζ régit la mémoire à long terme et se fixe sélectivement sur les synapses pour les renforcer demeurait un mystère.
[1] KIBRA anchoring the action of PKMζ
[2] Théorie sur la mémoire à long terme Francis Crick
[3] Du latin murinus, relatif aux rats et souris
[4] How does PKMζ maintain long-term memory?
Cette nouvelle étude1 (à la base de notre article) comble ces lacunes en identifiant la molécule responsable de la sélectivité de la PKMζ, une protéine dénommée KIBRA3 qui participe à l’organisation et au maintien de la structure des synapses et qui interagit de manière continue avec PKMζ. Au cours de cette étude, les expériences menées sur des modèles murins ont révélé que la protéine KIBRA agit comme un marqueur synaptique persistant, identifiant les synapses « fortes » et permettant à PKMζ de s’y lier de manière sélective. Même si ces protéines ont une durée de vie courte, le marquage synaptique persiste et permet à d’autres complexes KIBRA- PKMζ nouvellement formées de se fixer aux synapses fortes.
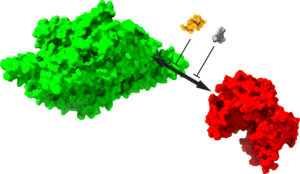
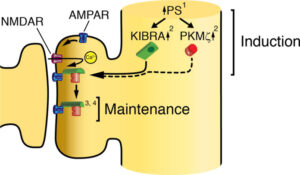
Figure 1 : (A) Représentation 3D de l’interaction KIBRA- PKMζ. La protéine structurale KIBRA (en vert) agit comme un marqueur constitutif des synapses fortes et se lie à PKMζ (en rouge). (B) Au sein du complexe synaptique, une stimulation afférente (à haute fréquence) active un certain type de récepteurs postsynaptiques (NMDARs). Il en résulte un afflux d’ions calcium au niveau de ces récepteurs post-synaptiques, ce qui amorce la PLT. À ce stade, il y a une augmentation de la synthèse protéique, ce qui induit une augmentation de la quantité de protéine KIBRA post-synaptique. Les protéines KIBRA se lient aux récepteurs AMPAR (connus pour jouer un rôle crucial dans la transmission synaptique excitatrice rapide dans le système nerveux central) ainsi qu’à la protéine PKMζ. Les composants du complexe sont probablement remplacés par de nouvelles molécules synthétisées afin de maintenir la PLT. Source : https://www.science.org/doi/10.1126/sciadv.adl0030
2. Applications potentielles
Cette découverte offre un nouveau cadre pour le développement des traitements contre les troubles cognitifs, tels que la maladie d’Alzheimer. L’implication de la protéine KIBRA dans la stabilité des connexions synaptiques suggère qu’elle pourrait exercer une fonction de modération dans les voies de signalisation qui sous-tendent la PLT, ce qui pourrait permettre de déterminer comment des perturbations dans ce complexe peuvent conduire à des dysfonctionnements de la mémoire, tels que ceux observés dans des maladies neurodégénératives. De fait, en ciblant l’interaction KIBRA-PKMζ, il serait possible de stabiliser ou de restaurer les souvenirs en cas de perte de mémoire ou de dégénérescence neuronale. En effet, les expériences menées au cours de ces recherches ont également montré que l’inhibition de la liaison entre les deux molécules contribuait à effacer des souvenirs datant d’un mois et perturbait la mémoire spatiale chez des souris. En revanche, une fois le marquage établi, les molécules individuelles sont renouvelées en permanence et se lient entre elles pour établir une mémorisation à long terme. Par ailleurs, la manipulation de l’interaction entre KIBRA et PKMζ pourrait permettre d’améliorer la consolidation de la mémoire à long terme et des applications dans l’apprentissage et le développement cognitif seraient envisageables, en particulier chez les personnes rencontrant des difficultés à former des souvenirs durables.
3. Enjeux à venir
Les découvertes sur l’interaction KIBRA-PKMζ marquent une avancée prometteuse dans la compréhension des mécanismes de la mémoire à long terme, ce qui ouvre des perspectives fascinantes pour les neurosciences, et en particulier dans le traitement des troubles amnésiques.
Toutefois, plusieurs limitations subsistent. D’une part, le complexe protéique KIBRA‑PKMζ possède une durée de vie limitée, ce qui pose la question de son remplacement dans le maintien de la mémoire à long terme. Bien que l’étude1 ait montré que l’interaction KIBRA‑PKMζ persiste, il reste à comprendre comment ces molécules sont renouvelées sans perturber la dynamique des synapses activées. D’autre part, on ne sait pas encore comment les interactions spécifiques entre KIBRA et PKMζ influencent l’expression des récepteurs (glutamatergiques) et d’autres protéines clés liées à la plasticité synaptique, et quelles sont les implications de ces mécanismes moléculaires dans le cadre d’un fonctionnement cognitif normal et pathologique. Par ailleurs, les applications cliniques nécessitent davantage de tests puisque les traitements expérimentaux ont, à l’heure actuelle, été validés uniquement sur des modèles animaux et devront, bien sûr, faire l’objet de longues années de recherche avant de pouvoir être utilisés sur des patients.

